
Startseite | Arbeitsguppe | Forschung | Publikationen | Veranstaltungen | Lehre | Offene Positionen | Anfahrt | Intranet
Deutsch | English

Startseite | Arbeitsguppe | Forschung | Publikationen | Veranstaltungen | Lehre | Offene Positionen | Anfahrt | Intranet
Deutsch | English

Die selektive Spaltung von Bindungen und die kontrollierte Knüpfung neuer Bindungen sind das zentrale Anliegen der chemischen Synthese. Durch kontrollierte Veränderung der molekularen Elektronendichteverteilung lassen sich solche Vorgänge steuern. Durch Stöße mit freien Elektronen werden die elektronische Struktur und damit die Reaktivität von Molekülen verändert. Abhängig von der kinetischen Energie der Elektronen werden Moleküle dabei in unterschiedliche reaktive Zustände überführt, so dass verschiedenartige Reaktionen ausgelöst werden.
Besonders drastische Veränderungen der Elektronendichte ergeben sich durch Hinzufügen oder Entfernen von Ladungen. Bereits Elektronen mit wenig mehr als thermischer Energie werden in vielen Fällen von Molekülen eingefangen. Dadurch entstehen reaktive, kurzlebige Radikalanionen. Je nach Energie des Elektrons dissoziieren diese auf unterschiedliche Weise. Diese dissoziative Elektronenanlagerung (DEA) liefert reaktiven Fragmente, die in kondensierter Phase Folgereaktionen eingehen und so neuer Produkte aufbauen.
Oberhalb der Ionisationsschwelle entstehen durch Entfernen eines Elektrons Radikalkationen, die prinzipiell ebenfalls zu Dissoziation neigen. Besonders interessant ist diese Art der Aktivierung, wenn die Moleküle in diesem Zustand intakt bleiben und vollständig an einen elektronenreichen Reaktionspartner addieren. Solche Additionsreaktionen sind durch die Coulomb-Wechselwirkung zwischen dem Radikalkation und dem Nukleophil stark begünstigt. Durch Rekombination mit einem weiteren Elektron resultiert ein stabiles neutrales Produkt.
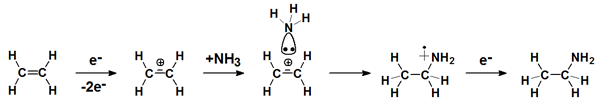
Dieser Typ von Reaktionen ist interessant, da das intakte Radikalkation die größtmögliche reaktive Spezies ist und daher Synthesen auslöst, die man als atom-effizient klassifizieren kann. Solche Synthesen sind von Bedeutung für unterschiedlichste Bereiche wie die Funktionalisierung von Oberflächen und die Astrochemie.
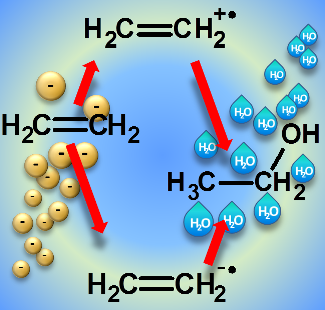
In speziellen Fällen kann auch die Anlagerung eines Elektrons Reaktionen auslösen, die zu einem identischen Produkt führen wie man es auch bei einem durch Ionisation getriebenen Mechanismus erhält. So wird Ethanol in Mischungen aus Wasser und Ethylen sowohl nach Elektronenstoß-Ionisation als auch in Folge der Anlagerung eines Elektrons an das Ethylen gebildet.
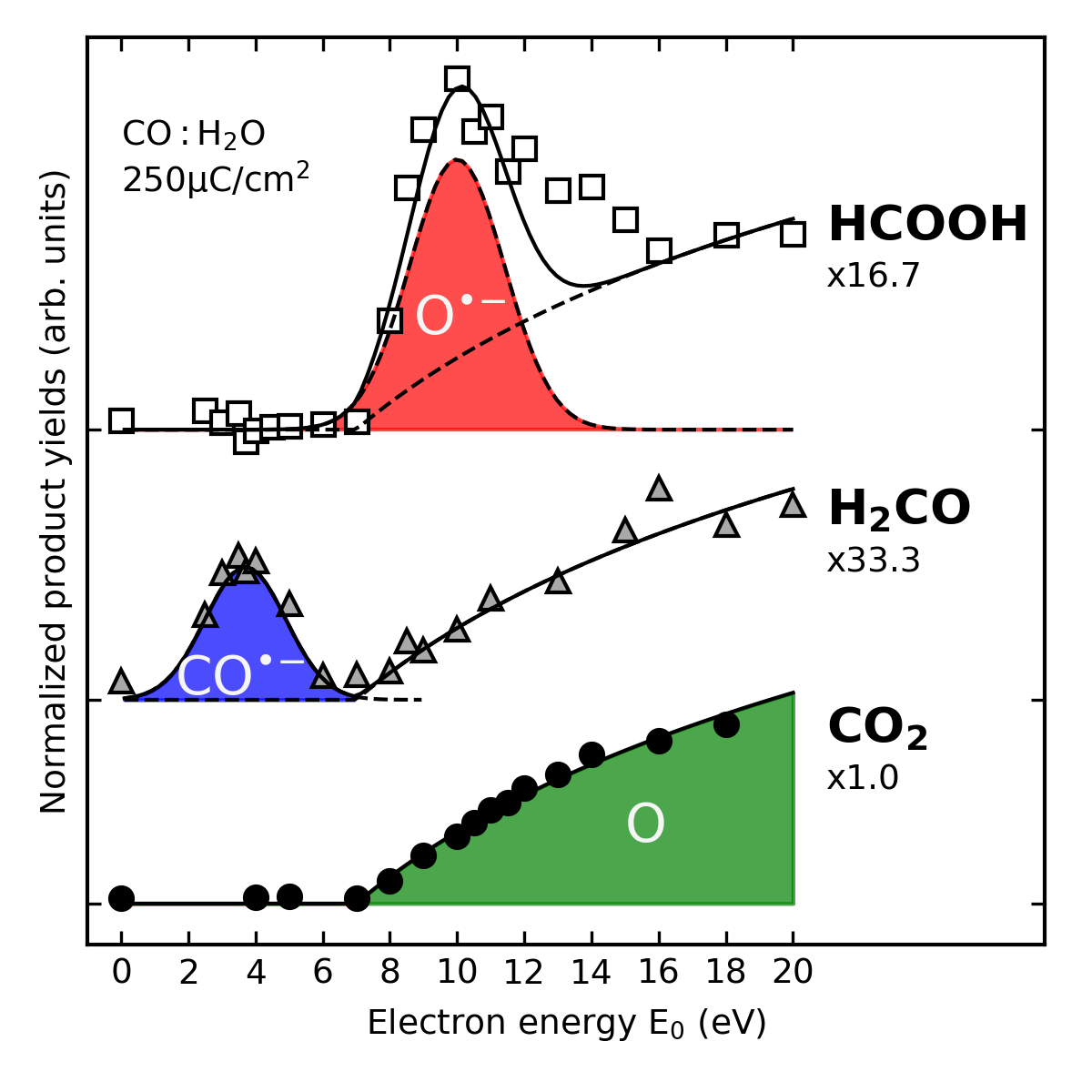
Die Energie der auftreffenden Elektronen bestimmt, welche reaktiven Fragmente auftreten und damit auch, welche Produkte gebildet werden. Experimente an Eismischungen aus CO und H2O mit hinreichend kleiner Schrittweite in der Energie zeigen, dass sich Formaldehyd und Ameisensäure in wohldefinierten Energiebereichen bilden. Dabei sind unterschiedliche anionische Intermediate beteiligt. Demgegenüber belegen das fehlende resonante Verhalten und die niedrige Schwelle für die Bildung, dass CO2 durch Reaktion von CO mit neutralem O entsteht.
Weitere Informationen:
(1) Mechanisms of methyl formate production during electron-induced processing of methanol–carbon monoxide ices (2021 PCCP HOT article);
F. Schmidt, P. Swiderek, J. H. Bredehöft,
Phys. Chem. Chem. Phys. 23, 11649-11662 (2021).
(2) Electron-Induced Processing of Methanol Ice;
F. Schmidt, P. Swiderek, J. H. Bredehöft,
ASC Earth Space Chem. 5, 391–408 (2021).
(3) Formation of Formic Acid, Formaldehyde, and Carbon Dioxide by Electron-Induced Chemistry in Ices of Water and Carbon Monoxide; F. Schmidt, P. Swiderek, J. H. Bredehöft, ASC Earth Space Chem. 3, 1974 (2019).
(4) Electron-induced formation of ethyl methyl ether in condensed mixtures of methanol and ethylene; F. Schmidt, P. Swiderek, J.H. Bredehöft, J. Phys. Chem. A 123, 37 (2019).
(5) Electron-induced synthesis of formamide in condensed mixtures of carbon monoxide and ammonia;
J.H.Bredehöft, E.Böhler, F. Schmidt T. Borrmann, P. Swiderek, ACS Earth Space Chem. 1, 50 (2017).
(6) Electron-induced hydration of an alkene: Alternative reaction pathways;
J. Warneke, Z. Wang, P. Swiderek, J.H. Bredehöft, Angew. Chem. Int. Ed. 54, 4397 (2015).
(7) Low-energy electron-induced hydroamination reactions between different amines and olefins;
E. Böhler, J.H. Bredehöft, P. Swiderek, J. Phys. Chem. C 118, 6922 (2014).
(8) Control of chemical reactions and synthesis by low-energy electrons;
E. Böhler, J. Warneke, P. Swiderek, Chem. Soc. Rev. 42, 9219 (2013).
(9) Reactions and anion desorption induced by low-energy electron exposure of condensed acetonitrile;
A.D. Bass, J.H. Bredehöft, E. Böhler, L. Sanche, P. Swiderek, Eur. Phys. J. D 66, 53 (2012).
(10) Elektronenstrahlen – neue Wege zur Reaktionskontrolle;
P. Swiderek; Nachrichten aus der Chemie 60, 1078 (2012).
(11) Low-energy electron-induced hydroamination of an alkene;
T.Hamann, E.Böhler, P.Swiderek, Angew. Chem. Int. Ed. 48, 4643 (2009).
Die Bilder sind von oben nach unten den Artikeln (8), (6) und (3) entnommen.